|
1、人流
1-1、人员净化流程图:
1-2、食品工业对人员、物料的动线有明确的规定,不可交叉流动,物料流动需设置专用的物料传递口或传递门;人员流动需走专用的人员通道。
2、按照生产工艺和卫生、质量要求,划分洁净级别,具体级别及要求:
|
|
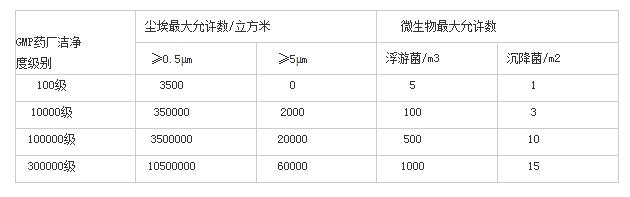
医药食品GMP厂房洁净级别及换气次数:
|

1、严格按照《ISO/DIS14644-1 国际标准》
2、《GB50073-2013 洁净厂房设计规范》
3、《GMP-98 药品生产质量管理规范》
4、《YFB001-95 医院洁净手术部建筑规范》
5、《GB14925-2001 实验动物环境与设施》
6、《YY0033-2000 无菌医疗器械生产管理规范》
7、《JGJ71-90 洁净室施工及验收规范》
生物制药企业要求GMP的目标是确保建立科学的、严格的无菌药品生产环境、工艺、运行和管理体系,最大限度地消除所有可能的、潜在的生物活性、灰尘、热原污染,生产出高品质的、卫生安全的药物产品。我们所说的生物制药净化工程-GMP洁净厂房工程解决方案和污染控制技术就是保证GMP成功实施的的主要手段之一;
通过对生物制药客户生产环境的深入研究和工程经验积累,我们清楚了解生物制药生产过程环境控制的关键;节能是我们系统方案优先考虑的重点;我们最擅长的就是给予客户符合GMP及Fed 209D, ISO14644, IEST, EN1822国际标准要求,同时应用了最新节能技术的环境解决方案;我们可以提供从GMP整厂规划设计——人流物流净化方案、洁净空调系统、洁净装饰系统;整厂节能改造、水电、超纯气体管道、洁净室监测、维护系统等全面安装配套服务;
生物制药净化工程-GMP洁净厂房工程解决方案说明:
一、 概述 :净化车间 净化工程 洁净工程 洁净车间 洁净厂房 无尘车间 无尘室的设计要求;
二、设计依据
1)<药品生产质量管理规范>(卫生部1992年修订);
2)<医药工业洁净厂房设计规范>(1997年)
3)<药品生产管理规范()实施指南>(1992)
4)<采暖通风与空气调节设计规范>(GBJ19-87)
5)<无菌医疗器具生产管理规范>(YY/T-0033-90)
三、净化车间按生产工艺和产品质量要求,分为一般生产区、控制区和。设人员换鞋区、男女一、二次更衣室、洗手、手消毒、洗衣间、洁净人流走廊、物流货淋走道。
四、人员流动方向:换鞋、更衣、洗手、手消毒--风淋室通道--洁净走廊--洁净车间
在净化车间及走廊设安全门, 便于人员疏散。
物品流动方向:物流通道---洁净车间--成品包装
五、 净化空调系统: 室内设计参数:
1):车间域10万级净化车间,
2)压力:洁净车间内保持正压, 与室外静+10PA
3):18~26℃; 4):50~65% ; 5)气流组织:a.上送车间内柱位下侧回风,上接管道回风至机房;三级过滤系统;
6) 新风量要保证内正压要求及人员无不适感, 保证室内新风量>40 M3/h.每人。
净化工程 http://www.szsjjt.com/ 洁净车间
苏州安净净化科技有限公司是一家净化产品生产的公司专业的净化工程 洁净车间 无尘室、净化车间 设计-施工- 彩钢板安装公司
净化工程安装公司电话: 0512-63208659 63208759 18936135399
|